A világ első galvánelemét Luigi Galvani fejlesztette ki. Olvasson a történetéről. ebben a cikkbenLényegében egy kémiai reakció által generált ideiglenes elektromos áramforrásról van szó. Az elektronok áramlását két különböző fém kölcsönhatása hozza létre. Ennek eredményeként a kémiai energia elektromos energiává alakul, amelyet aztán a mindennapi életben fel lehet használni.
A koncentrációs galvánelem egy olyan áramforrás, amely két azonos fémelektródából áll, amelyeket a fém sóinak különböző koncentrációjú keverékébe helyeznek.
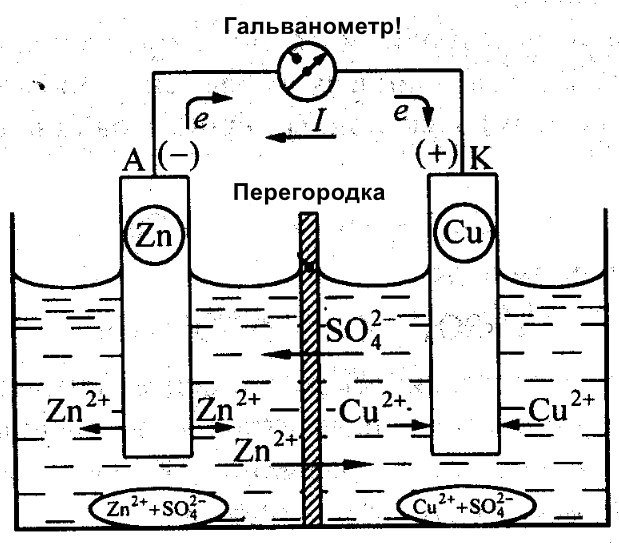
Galvani mellett Daniel Jacobi is egy hatékony akkumulátor megalkotásán dolgozott. Kissé módosította az energiaforrását. Ez egy CuSO4-be helyezett rézlemezből és egy ZnSO4-be merített cinklemezből áll. A közvetlen kölcsönhatásuk megakadályozása érdekében egy porózus falat helyeznek el közöttük. Az alábbiakban Daniel Jacobi galváncellájának ábrája látható.
A cink és a réz reakcióképessége eltérő, ezért a töltésük is eltérő lesz. Ennek eredményeként az elektródák szintje sem egyenletes. Ez lehetővé teszi számukra, hogy mozogjanak és elektromos vagy galvánáramot generáljanak. Ez az áram akkor kezd folyni, amikor egy személy vagy egy áramtároló eszköz feltalálója terhelést csatlakoztat. Ez a terhelés lehet egy villanykörte, egy rádió, egy számítógépes egér vagy más elektromos eszköz.
Galvanikus cella vázlatos rajza
Az áramköri rajz az összetételére és a szerkezetére utal. Több kémiai elemből is felépíthető segédeszközök segítségével. Az alábbiakban röviden ismertetjük a galvánelem szerkezetét. Olvasson róla bővebben ebben a cikkben.!
A galvánelem szerkezete
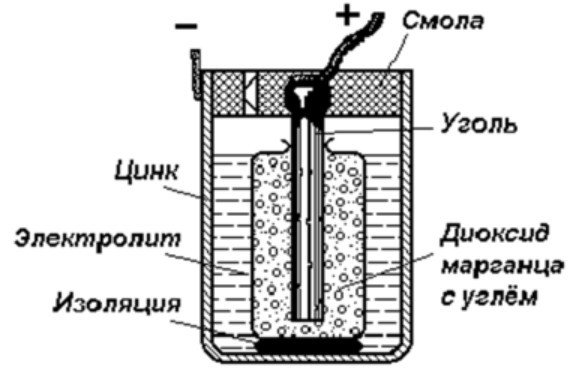
A legegyszerűbb energiatároló eszköz a következőkből áll:
- Szénrúd.
- Két különböző fém.
- Elektrolit.
- Gyanta vagy műanyag.
- Izolátor.
Amint az ábrán látható, egy galvánelem egy negatív és egy pozitív elektródából áll. Készülhetnek rézből, cinkből vagy más fémekből. Réz-cink celláknak nevezik őket. Néha szárazelemek.
Galvanikus cella megnevezése egy diagramon Két függőleges vonal formájában készül, amelyek kis távolságra vannak egymástól. Az egyik kisebb lesz. Mindegyik vonal szélén jelzések jelzik polaritásA hosszú vonal pozitív, a rövid vonal negatív pólussal van jelölve. A feszültségérték mellette látható. Ez azt jelenti, hogy az akkumulátort használó áramkör csak ezen a feszültségen működik.
A galvánelem működési elve
A galvánelem úgy működik, hogy elektronok mozognak egyik fémkontaktusról a másikra. Kémiai átalakulás történik. Tudjon meg többet a galvánelem termodinamikájáról és a galván elektromosság keletkezéséről. Itt.
Válaszok a gyakran ismételt kérdésekre
| Galvanikus | Magyarázat |
| Akkumulátor | Egy energiaforrás, amely egy zárt, miniatűr térben zajló folyamatokon keresztül működik. Konkrétan az energia kémiai reakció révén keletkezik. |
| Voltaikus cella vagy Voltaikus oszlop | Ez egy energiaelem, amelyet először egy Volt nevű tudós alkotott meg. |
| Folyamat | Kémiai elemek kölcsönhatása, amely elektromos áram létrejöttét eredményezi. |
| Mentesítés | Ez egy kémiai reakció befejeződése. Vagyis nem lesz kölcsönhatás az anyagok között. A galvánkisülés jelen van a Warframe-ben. Lényegében ez egy hiánycikk. Közelharci fegyverekhez használják. PolaritásV2. |
| Galvanikus érintkezés | Ez az elektródák és az oldat közötti érintkezés. |
| Hatás | Két, kétféle fémből készült érintkező közötti különbség megjelenése. A különbség nagysága a vezetők hőmérsékletétől és kémiai összetételétől függ. Lényegében ez Volta első törvénye. |
| Kapcsolat/láncszem/kapcsolat | Két vagy több elektromos áramköri szakasz csatlakoztatása áramforráshoz. |
| Galvanikus töltés | Az akkumulátor feltöltése energiával. |
A galvanizálás egy kémiai folyamat, amely elektromos áramot használ. A reakció során az oldott fémkationok mennyisége olyan mértékben csökken, hogy azok végül egyenletes bevonatot képeznek a fémelektróda felületén. Ennek eredményeként a tárgy tartósabbá válik, a kisebb horpadások eltűnnek, és a megjelenése is vonzóbbá válik.
Galvanikus cellák típusai
Többféle speciális akkumulátortípus létezik.
Galvanikus cellák táblázata
| Típus | Feszültség | Fő előnyök |
| Lítium | 3 V | Nagy kapacitás, nagy áramerősség. |
| Sóakkumulátorok vagy szén-cink | 1,5 hüvelyk | A legolcsóbb. |
| Nikkel-oxihidroxil-NiOOH | 1,6 volt | Nagy áramerősség. Nagy kapacitás. |
| Lúgos vagy lúgos | 1,6 V | Nagy áramerősség. Jó hangerő. |
Ezt a témát részletesebben tárgyalja a cikk. akkumulátorok típusai!
A galvánelem célja
Elektromos berendezések indítására tervezték. Ezek lehetnek például:
- Óra.
- Távirányítók.
- Zseblámpák.
- Orvosi berendezések.
- Laptopok.
- Játékok.
- Kulcstartók.
- Telefonok.
- Lézermutatók.
- Számológépek.
És hasonló dolgok körülöttünk.
Galvanikus cella otthon
Készíthetsz egy egyszerű áramforrást magad is. Ehhez a következő kellékekre lesz szükséged:
- Műanyag pohár.
- Elektrolit. Ez lehet sóoldat, szóda vagy vízben hígított citromsav.
- Két különböző fémből készült lemezek. Például alumínium és réz.
- Vezetékek
Gyártási folyamat
Fogj egy műanyag poharat, és öntsd bele az elektrolitot. Ne töltsd színültig; a legjobb, ha 1-2 centiméterrel rövidebbre hagyod. Rögzítsd a vezetékeket a fémlemezekhez. Ezután helyezd a réz- és alumíniumlemezeket a tartály széleire. Párhuzamosnak kell lenniük egymással. Ha minden készen áll, megmérheted a feszültséget egy voltmérővel.
Csatlakoztasd a készüléket, és érintsd a mérőfejeket az áramforrásunk érintkezőihez. Tartsd őket a helyükön, amíg a kijelzőn meg nem jelenik a feszültség. Általában 0,5-0,7 volt. Ezek az értékek az elektrolittól, pontosabban az elektrolitként használt anyagtól függenek.
Így készül egy házilag készített galvánelem.